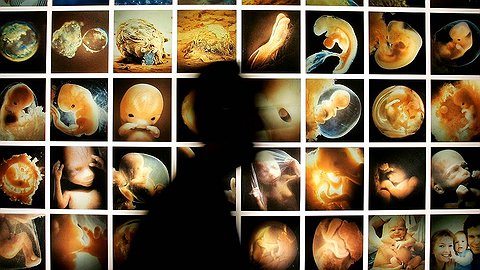
В мире выдана первая лицензия на редактирование человеческого генома. И пока одни ученые восторгаются открывающимися перспективами, другие хватаются за голову, опасаясь непредсказуемых последствий. В деталях сенсации разбирался "Огонек"
Страшный сон блюстителей биоэтики стал явью: британское Управление по оплодотворению и эмбриологии разрешило генетическую модификацию человеческих эмбрионов. А ведь только в декабре отшумел организованный академиями наук США, Великобритании и Китая Международный саммит в Вашингтоне, на котором эксперты недвусмысленно объявили ученым: эксперименты с геномом человеческих эмбрионов проводить не рекомендуются, так как пока технологии недостаточно надежны, а последствия — непредсказуемы. Экспертное сообщество приняло резолюцию, согласно которой нужно как следует оценить риски, альтернативы, потенциальную выгоду,— в общем, нужны гарантии. Но англичане — сами себе законодатели, сами себе взяли и разрешили.
Преодолевшая океан
Теперь доктор Кэти Ниакан из Института им. Фрэнсиса Крика — первая в мире обладательница лицензии на лабораторное исследование, в ходе которого она станет перекраивать человеческую ДНК прямо внутри оплодотворенной клетки. Цель Кэти — выявить причины, которые провоцируют выкидыши. Она хочет понять, какие именно гены необходимы на самых ранних сроках беременности для успешного развития эмбриона. Пол Нэрс, начальник Кэти и директор Института Крика, уточнил, что полученные данные позволят увеличить успешность экстракорпорального оплодотворения (ЭКО). К слову, в мире ежегодно из пробирки появляется более 30 тысяч младенцев, что составляет всего 30-40 процентов от предпринимаемых попыток забеременеть таким образом. Остальные заканчиваются неудачами.
Противники вмешательства в ДНК пугают общественность непредсказуемыми последствиями для потомства, а еще говорят, что, имея возможность "проектировать" будущего ребенка, мамы и папы станут заказывать ему цвет глаз и уровень интеллекта. Дискриминация получится. Однако ученые отмахиваются от подобных мелочей в ожидании колоссальных возможностей, одна из которых вполне реальна: спасти человечество от неизлечимых до сих пор болезней, передающихся по наследству.
— Исследовательница Кэти Ниакан приехала в Англию из-за океана, поскольку на родине у нее такие исследования невозможны,— рассказывает "Огоньку" вице-президент Российского национального комитета по биоэтике РАН профессор Борис Юдин.— В США, да и в континентальной Европе, к этому вопросу относятся очень жестко. Конвенция Совета Европы по биоэтике против вмешательства в геном человеческого эмбриона. Поэтому Великобритания и не присоединяется к этой Конвенции. Но тут есть тонкость. В Великобритании при правительстве работает специальная структура, которая дает или не дает разрешение в каждом конкретном случае. В данном случае дали. Но тут были поставлены жесткие условия: эмбрион не должен достигать 12 дней и категорически запрещено имплантировать генетически модифицированные эмбрионы женщинам.
Вырезать по образцу
И все-таки предприимчивая Кэти Ниакан не является пионером в редактировании эмбрионов. В 2015 году, в обход запретов, подобный эксперимент уже провели китайские генетики из Гуанчжоу. В апреле прошлого года они опубликовали статью в журнале Protein & Cell, где описали, как отредактировали человеческие эмбрионы. Это удалось сделать с помощью CRISPR/Cas9 — особой молекулярной системы, которая "умеет" вырезать дефектные участки гена и заменять их на здоровые. Вот это была действительно первая в истории попытка генетически модифицировать человека.
Китайские ученые замахнулись на эмбриональную коррекцию бета-талассемии — заболевания крови, при котором мутантный ген передается по наследству. Внутрь яйцеклеток внесли фрагмент неповрежденного гена гемоглобина, а также молекулярную систему CRISPR/Cas9, которая должна была заменить мутантный ген в хромосоме. Однако из 86 оплодотворенных яйцеклеток отредактировать, то есть исправить поломанный ген, удалось только у 4 эмбрионов.
— Неизвестно, то ли китайцам не повезло, то ли они просто плохо провели эксперимент,— говорит заведующий лабораторией регуляции экспрессии генов Института молекулярной генетики РАН, профессор Университета Ратгерса (США) Константин Северинов.— Технология CRISPR/Cas9 успешно используется для создания трансгенных животных, и в лабораториях имеется большое количество мышей, крыс, дрозофил и червяков, геномы которых были отредактированы с помощью этой технологии на стадии эмбриона. Ведь если забыть об этических соображениях, с точки зрения биологии мышиная и человеческая клетки очень похожи.
Нобелевская премия для бактерий
Технологию CRISPR/Cas человек подсмотрел у бактерий, они борются с ее помощью с паразитами — вирусами и плазмидами. В начале 2000-х годов биоинформатик, сотрудник Национального центра биотехнологической информации США, один из первых исследователей молекулярной системы CRISPR Евгений Кунин выяснил, что у бактерий есть своя очень интересная иммунная система.
— CRISPR — это молекула РНК, а Cas — это белок, в данном случае они работают в тандеме,— объясняет Константин Северинов, один из немногих ученых, который занимается подобными исследованиями в России.— Если ввести этот белок и РНК одновременно в клетку, то РНК будет "нацеливаться" на поломку гена, а Cas — "вырезать". Выяснилось, что ровно то же самое работает в клетках высших организмов, например человека.
После того как в 2003-м был расшифрован геном человека, ученые стали подбираться к тому, чтобы использовать систему CRISPR/Cas у человека. Первая публикация о такой возможности была сделана в январе 2013 года. А сам эксперимент — спустя всего два года. Китайский опыт CRISPR стал научным прорывом 2015 года. Некоторые ученые прочат разработчикам CRISPR Нобелевскую премию.
— Не очень понятно, за что именно давать Нобелевскую премию,— возражает Северинов.— За "открытие", которое сделали бактерии в процессе эволюции и которое было предсказано биоинформатиками и подтверждено микробиологами? Или за то, что другие люди придумали, как это применять, и развили полезную технологию? У большинства современных открытий нет единственного автора. Есть две замечательные девушки, Дженнифер Дудна и Эмманюэль Шарпантье, которые первыми опубликовали статью о возможности применения CRISPR/Cas9. Им все хотят дать награду, и они в некотором смысле этого заслуживают. Но существуют и другие ученые, заслуги которых ничуть не меньше, хотя они, конечно, менее привлекательны. То, что Кэти Ниакан получила разрешение на эксперимент с геномом человеческих эмбрионов, действительно большой прорыв именно с точки зрения возможности двигаться дальше. Что это случится рано или поздно, ни у кого сомнений не было. Институт Фрэнсиса Крика — один из лучших мировых центров биомедицинской науки. Исследования будут проходить под строгим контролем, 11 дней развития более чем достаточно, чтобы оценить точность, качество редактирования. Никто не будет создавать новых детей, имплантировать женщинам генетически модифицированных зародышей. Эмбрионы возьмут из излишков, оставшихся после ЭКО. У религиозных людей может возникнуть вопрос о душе, есть ли она уже у подобных эмбрионов. Тут полезно вспомнить, что по всему миру в клиниках по искусственному оплодотворению хранятся десятки тысяч таких вот "душ" в замороженном виде. Их, как правило, через определенное время просто выкидывают. Так не лучше ли использовать их для исследований, результаты которых могут помочь людям в будущем, так же, как случилось с ЭКО?
Верхом на вирусе
Ученые не сомневаются, что законодательные ограничения с эмбриональными экспериментами медленно и верно будут сокращаться. Когда речь идет о генной медицине, сдерживать науку бессмысленно: постепенно будет возрастать давление со стороны семей с различными неизлечимыми ранее генетическими заболеваниями и со стороны бездетных пар. Метод экстракорпорального оплодотворения тоже в свое время вызывал сомнения, но доказал состоятельность. Считая с 1978 года, количество счастливо рожденных граждан из пробирки перевалило за миллион. Биологи уверены, что после выполнения всех стандартных требований по безопасности это будет введено в медицинскую практику с людьми и с животными.
— Необязательно будут редактироваться эмбрионы, можно редактировать стволовые или зрелые дифференцированные клетки, все что угодно! — говорит профессор Северинов.— Я думаю, что первыми будут излечиваться различные болезни крови, такие как лимфома. Может быть, на какой-то стадии научатся лечить муковисцидоз. Синья Яманака, лауреат Нобелевской премии, специалист по стволовым клеткам, считает, что это будут заболевания сетчатки глаза. Ну у всех свои любимые штучки. По идее, с помощью этого метода, диагностируя и пролечивая эмбрионально, можно лечить или не давать развиваться всем простым моногенным болезням. Другое дело, что с помощью CRISPR/Cas невозможно вылечить болезни, которые вызываются поломками сразу нескольких генов.
Ученые предсказывают, что экспериментальную геномную терапию на добровольцах начнут проводить к 2025 году. До тех пор CRISPR/Cas может закрыть, например, проблему донорства органов. Недавно генетик Джордж Черч из Гарварда опубликовал результаты геномного излечивания клетки свиньи от ретровируса.
Известно, что свиные органы используются для трансплантации человеку. Из пролеченной клетки несложно вырастить здоровую свинью, которая сможет спасти человеческую жизнь. Но чтобы полностью решить проблему иммунной совместимости, нужно применять CRISPR/Cas непосредственно к человеку. И необязательно на эмбриональной стадии. Технология позволяет менять клетки и взрослого человека.
Стоп-сигнал
Требования безопасности, как обычно, противоречат скорости развития науки. Пока биоэтики привыкают к мысли о неизбежности генетических модификаций эмбрионов, ученые трудятся над техническим повышением точности CRISPR/Cas. Изучают, как именно на молекулярном уровне происходит узнавание мишени, и изменяют Cas-белок, чтобы он стал более точным. Кроме того, не прекращается поиск новых систем CRISPR/Cas. Этим занимаются и Евгений Кунин, и Фен Чжанг, держатель всех патентов на CRISPR, и Константин Северинов. Основная цель ученых — повысить точность и уменьшить размер белка Cas, который сам по себе довольно велик, что усложняет его доставку в клетки млекопитающих. Ведь к цели белок попадает верхом на вирусе, транспортные возможности которого ограниченны.
— В нашей работе есть не только технологические аспекты, но и чисто научные, которые потрясают,— рассказывает Константин Северинов.— Например, один из самых интересных фундаментальных вопросов состоит в том, что CRISPR/Cas — это практически единственный знакомый ученым случай Ламарковской наследственности, когда изменения окружающей среды передаются по наследству и закрепляются в генах потомства. Поясняю на примере: представить себе, что жираф тянулся за листиками наверх и вытянул шею, и его дети поэтому тоже стали иметь длинную шею. Это полная анафема для дарвинистов! Но именно так в природе работают системы CRISPR/Cas, защищая бактерии от вирусов.
Пока ученые наслаждаются исследовательским процессом, эксперты оценивают риски. Ведь генетики заявляют, что редактирование эмбриона с помощью CRISPR/Cas — дело рисковое, но нехитрое. Так что на поверхности лежит опасение, как бы новая технология не оказалась на службе у какого-нибудь нечистоплотного медика.
— Не думаю, что это возможно,— успокаивает Борис Юдин.— Хотя в современном мире есть такая тенденция: некоторые люди, не являясь профессиональными учеными, начинают подобными вещами интересоваться, предпринимают самостоятельные попытки делать какие-то исследования, скажем, у себя в гараже. Это есть. Но я не думаю, что с редактированием генов такое можно сделать. Мне кажется, это направление будет развиваться спокойно и последовательно, шаг за шагом, под строгим контролем, с учетом этических ограничений. Которые, правда, в ходе дискуссий будут постоянно пересматриваться.
Кто нас поправит
Визитная карточка
Константин Северинов родился в 1967 году в Ленинграде, с отличием окончил биофак МГУ по специальности "Биохимия", проходил стажировку в Бристольском университете, поступил в аспирантуру Института молекулярной генетики РАН и по программе Джорджа Сороса уехал работать в лаборатории Колумбийского университета США. После защиты диссертации работал в Рокфеллеровском университете. В 1997 году стал профессором Института микробиологии Ваксмана в Ратгерском университете, где заведует сейчас лабораторией. С 2005 года много времени проводит в России, организовал группу в Институте молекулярной генетики, финансировал ее работу за счет своей американской лаборатории, пока не получил правительственный грант. С 2006 года — доктор биологических наук. Специализируется в области регуляции транскрипции генов бактерий. Заведует Лабораторией регуляции экспрессии генов мобильных элементов прокариот в Институте молекулярной генетики РАН и Лабораторией молекулярной генетики микроорганизмов в Институте биологии гена РАН. Обе лаборатории исследуют микроцины и бактериофаги, финансируются за счет различных грантов. Константин Северинов является профессором Сколковского института науки и технологий (SkolTech).
Борис Юдин родился в 1943 году в Москве, окончил МВТУ им. Баумана, был инженером-конструктором НИИ металлургического машиностроения. Доктор философских наук с 1986 года, профессор с 1987 года, член-корреспондент РАН с 2000 года. В 1991 году стал завсектором биоэтики, а затем и директором Института человека РАН. С 1992 года — вице-президент Российского национального комитета по биоэтике РАН. С 2006 года руководил Центром биоэтики Института гуманитарных исследований Московского гуманитарного университета. С 1997 года представляет Россию в Комитете по биоэтике Совета Европы. С 2004 года — действительный член Международной академии наук. С 2015 года — председатель этического комитета при Министерстве здравоохранения РФ.